IsoValley
UDI 밸리데이션
UDI (UDI Validation)
의료 산업의 많은 업체에서 바코드 라벨 제작 시스템이 다양한 규정을 준수하도록 힘쓰고 있습니다.
FDA(Food and Drug Administration)는 미국 내에서 유통되는 모든 의료 기기에 UDI(Unique Device Identifier)가 포함된 라벨이 부착되어 있어야 한다고 규정하고 있습니다.
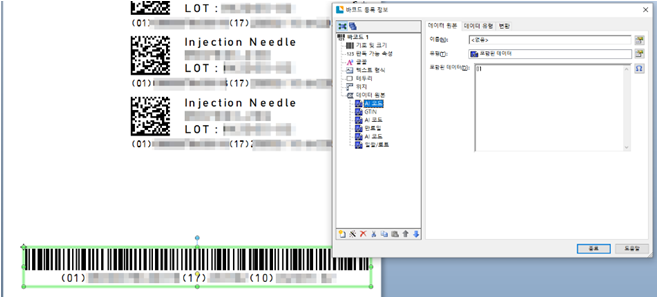
UDI는 공급망에서 의료 기기를 표시하고 식별하는 데 사용되는 고유한 숫자 또는 영숫자 코드로 구성합니다.
FDA(Food and Drug Administration)는 미국 내에서 유통되는 모든 의료 기기에 UDI(Unique Device Identifier)가 포함된 라벨이 부착되어 있어야 한다고 규정하고 있습니다.
UDI는 공급망에서 의료 기기를 표시하고 식별하는 데 사용되는 고유한 숫자 또는 영숫자 코드로 구성합니다.
결과적으로 이식이 가능한 모든 생명 지원/생명 유지 의료 기기에 UDI 라벨이 있어야 하며,
UDI를 통해 오류를 줄이고, 데이터 시스템 통합을 간소화하며, 문제 해결을 위해 보다 빠른 솔루션을 제공하는 역할을 합니다. 완벽한 UDI 준수에는 다음 세 구성요소를 포함하여야 합니다.
- 품질 시스템, 의료 기기 보고, 수정 및 제거를 비롯하여 적용 가능한 모든 시스템과 절차에 UDI를 포함합니다.
- 지정된 모든 정보를 포함하여 장치와 포장에 정확한 라벨을 부착합니다.
- 연관된 모든 정보와 함께 DI(Device Identifier)를 GUDID(Global Unique Device Identification Database)로 로드.
UDI를 통해 오류를 줄이고, 데이터 시스템 통합을 간소화하며, 문제 해결을 위해 보다 빠른 솔루션을 제공하는 역할을 합니다. 완벽한 UDI 준수에는 다음 세 구성요소를 포함하여야 합니다.
- 품질 시스템, 의료 기기 보고, 수정 및 제거를 비롯하여 적용 가능한 모든 시스템과 절차에 UDI를 포함합니다.
- 지정된 모든 정보를 포함하여 장치와 포장에 정확한 라벨을 부착합니다.
- 연관된 모든 정보와 함께 DI(Device Identifier)를 GUDID(Global Unique Device Identification Database)로 로드.
-
설치 적격성 평가
(Installation Qualification, IQ)설치물의 모든 주요 부분이 관련 법규와 승인된 규격 및 설계 의도에 적합하며
납품 업체가 발주자의 권사항에 적합하게 설치하였다는 건에 대한 문서화를 증명으로
설비가 적절히 설계되어 있는지,안전하게 작동할 수가 있는지
그리고 작동 및 유지보수에 관한 문서들이 작성되어 있고
관련부서에 전달되어 있는지 확인하는 절차입니다. -
운전 적격성 평가
(Operational Qualification, OQ)해당 설비 및 부대 시스템/서브 시스템에 예상한 운전 범위 안에서 올바르게 작동되고 있으며,
향후에 운전 작업도 신뢰할 만하고 규정된 범위 내에 있을 것임을 문서로 보증하는 것이다.
모든 작업은 문서화되어야 하고 설비의 사용 기록서에도 기록되어야 한다.
OQ, PQ는 ‘최악의 조건’을 포함하는 실제적인 사용 조건들을 조장하여 이루어진다.
평가에서는 신뢰할 수 있고 의미 있는 결과를 보증하기 위해 충분한 횟수로 반복되어야 한다.
평가 중 설비/시스템이 규격 이내에서 운전되지 않을 경우는 실패의 원인을 찾기 위한 조사가 이루어져야 하며, 수정이 이루어지고 필요한 경우에는 재검증이 이루어져야 한다.
OQ에서는 소프트웨어 검증 등이 포함될 수 있다.